 |
 |
 |
 |
情報収集 |
目標とする疾患、薬になりそうな候補や市場性などの情報を集める |
 |
| 目標の設定 |
情報をもとに、研究する分野や目標を定める |
 |
| 薬物デザイン |
どのような化合物が薬として有効化を探索 |
 |
| 合成 |
原子を設計通りに組み合わせて、これまでにない化合物を作り出す |
 |
| 基礎評価 |
化合物が治験に効果があるのか、毒性はないか探索 |
| 特許出願 |
化合物を特定し、有効であれば特許取得を行う |
 |
 |
 |
 |
 |
スクリーニング |
動物実験で安全性や効果等を調査 |
 |
| 治験届 |
人体での効果を調べるため、計画書を厚生労働省に提出 |
 |
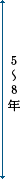 |
 |
第一相試験
<フェーズⅠ> |
少数の健常な大人で安全性を調べる |
 |
第二相試験
<フェーズⅡ> |
同意を得た少数の患者で効果、使用法、副作用を調べる |
 |
第三相試験
<フェーズⅢ> |
同意を得た多数の患者を対象に、薬としての有用性を調べる |
 |
 |
 |
 |
申請・承認審査 |
厚生労働省に薬の製造・販売の承認を申請。専門化が適性を審査 |
 |
| 承認 |
承認されて初めて薬として販売可能に。健康保険での薬価が決定 |
 |
 |
 |
 |
販売 |
発売後、cGMP※に基づいて製造。
追跡調査を実施し、有効性や安全性を調査 |
 |
 |
| ※cGMP…current Good Manufacturing Practiceの略。米国食品医薬品局の医薬品の製造管理および品質管理に関する基準 |










